
中学教师资格考试(高级化学学科知识与教学能力)模拟试卷59
单项选择题
1.两瓶气体分别为NO2和Br2蒸气,外观均相同。某同学设计了各种鉴别法,其中正确的是( )。
①用湿润的淀粉KI试纸 ②加少量NaCl溶液
③加少量AgNO3溶液 ④加少量水后再加少量苯
⑤一定条件下改变温度(C)
A. 只能采用①②③
B. 能采用①②③④
C. 只能采用②③④⑤
D. 都可以
解析:①NO2和Br2蒸气均能氧化KI中的碘离子生成碘单质,碘遇淀粉变蓝,现象相同,不能鉴别;②加少量NaCl溶液后,NO2与水反应生成硝酸与NO,红棕色褪去,Br2蒸气溶于水后有颜色,现象不同,可以鉴别;③NO2通入AgNO3溶液中,有气体生成,而Br2蒸气通入AgNO3溶液中生成浅黄色沉淀AgBr,现象不同,可以鉴别;④NO2和Br2蒸气都是红棕色气体,NO2与水反应生成硝酸和无色的一氧化氮气体,而Br2蒸气溶于水,溶液颜色为橙红色,加苯分层,二者现象不同,可以鉴别;⑤一定条件下改变温度,改变温度导致2NO2
2.在一定条件下,关于密闭容器中进行的反应:N2(g)+3H2(g) (B)
(B)
A. 正、逆反应速率都等于零
B. N2、H2、NH3的浓度均不再变化
C. N2、H2、NH,在容器中共存
D. N2、H2、NH3的浓度相等
解析:达到平衡状态后,正逆反应速率相等,反应仍在进行,所以正、逆反应速率不等于零,A项错误。各组分浓度不变,正逆反应速率相等,达到了平衡状态,B项正确。反应开始后,N2、H2、NH3在容器中共存,但不能说明达到化学反应平衡,C项错误。N2、H2与NH3的浓度相等,无法判断各组分浓度是否变化,所以无法判断化学反应是否已经达到平衡,D项错误。
3.用NA表示阿伏加德罗常数。下列说法正确的是( )。(C)
A. 78 gNa2O2与足量水反应中电子转移了0.2NA
B. 1 mol甲基中含有7NA个电子
C. 62 g白磷中含有P—P键为3NA
D. 标准状况下,22.4 L水中含氢原子数为2NA
解析:78 g过氧化钠的物质的量为1 mol,1 mol过氧化钠与足量水反应生成0.5 mol氧气,转移了1 mol电子,即电子转移了NA;甲基的电子式为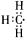
4.下列有关实验的操作过程的叙述,正确的是( )。(C)
A. 酸碱滴定过程中,用待滴定溶液润洗锥形瓶以减小实验误差
B. 比较硫与碳的非金属性强弱,用玻璃棒分别蘸取相同浓度的Na2CO3、Na2SO3溶液滴在pH试纸上,测pH待查证
C. 检测某种绿色溶液中含有Fe2+:取该溶液少许向其中加入KSCN溶液,不变红色,再向其中滴加氯水,溶液变为红色
D. 出分液漏斗中所需的上层液体,当下层液体从液漏斗下端口留出后,及时关闭活塞,然后更换一个接收器,打开活塞将分液漏斗中的液体放出
解析:酸碱滴定过程中,用待滴定溶液润洗锥形瓶,相当于增加了待测液的量,会使实验结果偏高,A项错误。比较硫和碳的非金属性强弱,应比较硫和碳最高价氧化物对应的水化物的金属盐的pH的大小,而Na2SO3不是硫最高价氧化物对应的水化物的金属盐,B项错误。C项正确。取分液漏斗中的上层液体,上层液体从上口放出,下层液体从下口放出,以免液体相互污染,D项错误。
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )。(C)
A. pH=1的溶液中:Na+、K+、MnO4–、CO32-
B. c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3–
C. 0.1 m01/L NH4HCO3溶液中:K+、Na+、NO3–、Cl–
D. 0.1 mol/L FeCl3溶液中:Fe2+、NH4+、SCN–、SO42-
解析:pH=1的溶液呈强酸性,
本文档预览:3000字符,共12524字符,源文件无水印,下载后包含无答案版和有答案版,查看完整word版点下载