
2019年下半年中学教师资格考试(高级化学学科知识与教学能力)真题试卷
单项选择题
1.下列说法正确的是( )。(C)
A. pH试纸有广范和精密两种,广范pH试纸测量范围较广,测量精度高
B. 意大利科学家阿伏加德罗总结了平衡移动原理
C. 用于比色分析的分光光度计可用在测定化学反应速率的实验中
D. 人类先后发明了电子显微镜、光学显微镜、扫描隧道显微镜
解析:pH试纸有广范和精密两种,广范pH试纸测量范围较广,但精密pH试纸的精密度较高,A项错误。平衡移动原理是勒夏特列总结出来的,B项错误。在溶液中,当反应物或生成物本身有较明显的颜色变化时(其吸光度不同),可用颜色深浅和显色物质浓度间的正比关系来跟踪反应过程并测量化学反应速率,C项正确。人类在研究物质微观结构过程中,三种不同层次的观测仪器使用的先后顺序为光学显微镜、电子显微镜、扫描隧道显微镜,D项错误。
2.下列反应的离子方程式正确的是( )。(D)
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B. 向NaAlO2溶液中通入过量CO2:2AlO2–+CO2+3H2O=2Al(OH)3↓+CO32-
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2–+2H2O+4NH4+
D. 向NaClO溶液中通入NH3:3ClO–+2NH3=N2+3Cl–+3H2O
解析:向稀HNO3中滴加Na2SO3溶液,二者发生氧化还原反应,反应的离子方程式为2H++2NO3–+3SO42-=3SO42-+2NO↑+H2O,A项错误。向NaAlO2溶液中通入过量的CO2,反应的离子方程式为AlO2–+CO2+2H2O=Al(OH)3↓+HCO3–,B项错误。Al(OH)3不溶于弱碱,因此向Al2(SO4)3溶液中加入过量氨水的离子方程式为Al3++3NH3·H2O=AI(OH)3↓+3NH4+,C项错误。次氯酸钠为氧化剂,与NH3反应生成N2,D项正确。
3.下列装置能达到实验目的的是( )。
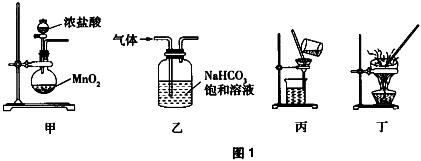 (C)
(C)
A. 用装置甲制取氯气
B. 用装置乙除去氯气中少量氯化氢得到纯净氯气
C. 用装置丙分离二氧化锰固体和二氯化锰溶液的混合物
D. 用装置丁做粗盐提纯时应将食盐水蒸干后停止加热
解析:浓盐酸和MnO2制氯气时应加热,A项错误。Cl2、HCl和NaHCO3均能反应,且反应还会生成CO2,引入新的杂质,不能得到纯净的Cl2,B项错误。二氧化锰是难溶物,可以用过滤的方法分离二氧化锰固体和二氯化锰溶液的混合物,C项正确。做粗盐提纯时,当蒸发皿中出现较多固体时,停止加热,用余热蒸干剩余的溶液,而不能等蒸干后再停止加热,D项错误。
4.短周期元素W、X、Y、Z的原子序数依次增大,它们均不是稀有气体元素,W、X、Y、Z的最外层电子数与其电子层数的比值依次为2、3、1/3、2。下列关于这些元素叙述错误的是( )。(D)
A. X和其他三种元素均可形成至少两种二元化合物
B. W和X、Z两种元素分别形成的二元化合物,均为直线形分子
C. W、X和Y三种元素所形成化合物的水溶液呈碱性
D. Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
解析:短周期元素W、X、Y、Z的原子序数依次增大,且均不是稀有气体元素,Y的最外层电子数与其电子层数的比值为1/3,则Y有3个电子层,最外层电子数为1,所以Y为Na元素;Z的原子序数比Na大,故Z处于第三周期,Z的最外层电子数与其电子层数的比值为2,则Z的最外层电子数为6,故Z为S元素;W、X原子序数小于Na元素,W、X的最外层电子数与其电子层数的比值依次为2、3,故W、X处于第二周期。W、X的最外层电子数分别为4、6,故W为C元素,X为O元素。x为O元素,与C元素可形成CO2、CO,与Na元素可形成Na2O、Na2O2,与S元素可形成SO2、SO3,A项正确。W为C元素、X为O元素、Z为S元素,W和X、Z两种元素分别形成的二元化合物为CO2、CO、CS2,CO2、CO是直线形分子,CS与CO2的结构类似,也属于直线形分子,B项正确。W、X和Y三种元素可以形成Na2本文档预览:3000字符,共14475字符,源文件无水印,下载后包含无答案版和有答案版,查看完整word版点下载