
中学教师资格考试(高级化学学科知识与教学能力)模拟试卷75
单项选择题
1.下列能反映出固态氨属于分子晶体的事实是( )。(A)
A. 常温下氨是气态物质
B. 氨极易溶于水
C. 氮原子不能形成阳离子
D. 氢离子不能单独存在
解析:分子晶体是通过分子间作用力(包括范德华力和氢键)构成的晶体。分子晶体的熔沸点比较低,离子晶体和原子晶体的熔沸点都比较高。所有常温下呈气态的物质、液态的物质(除汞外)和易挥发的固态物质都属于分子晶体。
2.下列说法正确的是( )。(B)
A. 增加体系压强,活化分子百分数增加,化学反应速率一定增大
B. 升高温度,活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的碰撞均为有效碰撞
D. 加入反应物,活化分子百分数大大增加,化学反应速率增大
解析:增加体系压强,物质浓度增大,活化分子浓度增加,化学反应速率增大,但活化分子数不变;升高温度,活化分子百分数增加,化学反应速率一定增大;活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞;加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大。
3.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: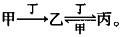 (A)
(A)
A. 若甲为Fe,则丁可能是Cl2
B. 若甲为焦炭,则丁可能是O2
C. 若甲为SO2,则丁可能是NaOH溶液
D. 若甲为AICl3溶液,则丁可能是NaOH溶液
解析:若甲为Fe,丁为Cl2,则甲和丁生成乙即FeCl3,FeCl3,与Cl2不能继续反应,A项错误。

4.绿原酸亦称咖啡鞣酸,是重要的中药成分之一。其结构式如图1所示:
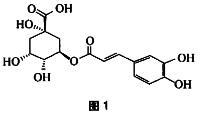 (C)
(C)
A. 其分子结构中有酯键、不饱和双键及多元酚三个不稳定部分
B. 与苯环直接连接的原子都在同一平面上
C. 1mol绿原酸水解时最多可以消耗6mol NaOH
D. 与浓溴水既能发生取代反应又能发生加成反应
解析:1mol绿原酸水解时最多可以消耗4molNaOH。
5.气体X只可能含有NH3、Cl2、HBr、CO2中的一种或几种。已知X通入硝酸银溶液时产生淡黄色、不溶于稀硝酸的沉淀,若将X通入澄清石灰水中没有沉淀产生。则下列有关气体X的成分的说法正确的是( )。(C)
A. 一定含有溴化氢、二氧化碳
B. 一定不含二氧化碳
C. 一定不含氨气、氯气
D. 可能含有二氧化碳和氯气
解析:X通入硝酸银溶液产生不溶于稀硝酸的淡黄色沉淀,可知X中一定含有溴化氢,因氨气和溴化氢可以反应生成溴化铵,氯气与溴化氢发生氧化还原反应,则X中一定没有氨气和氯气,由于碳酸钙可溶于强酸中,故在溴化氢存在的条件下,X若有二氧化碳,通入澄清石灰水中也可能没有沉淀生成,所以无法判断二氧化碳是否存在。故本题选C。
6.室温下,下列各组离子在指定溶液中能大量共存的是( )。(B)
A. 0.1mol·L-1KI溶液:Na+、K+、ClO–、OH–
B. 0.1mol·L-1Fe2(SO4)3溶液:Cu2+、NH4+、NO3–、SO42-
C. 0.1mol·L-1HCl溶液:Ba2+、K+、CH3COO–、NO3–
D. 0.1mol·L-1NaOH溶液:Mg2+、Na+、SO42-、HCO3–
解析:I–和ClO–可以发生反应,不能大量共存,A项错误。H+可以和CH3COO–结合成弱电解质CH3COOH,不能大量共存,C项错误。OH–可以和Mg2+、HCO3–发生反应,不能大量共存,D项错误。故本题选B。
7.下列分子中,中心原子成键轨道采取不等性sp3杂化的是( )。(D)
A. BF3
B. CH4
C. C2H4
D. NH3
解析:不等性杂化的特点是参加杂化的各原子轨道中所含的未成对电子数不相等,杂化后所生成的各杂化轨道的形状和能量不完全等同。NH3分子中的N原子的外层电子构型为2s22p3,成键时进行sp3杂化。但由于原先s轨道中已含一对孤对电子,因此杂化后4个s
本文档预览:3000字符,共14651字符,源文件无水印,下载后包含无答案版和有答案版,查看完整word版点下载