
中学教师资格认定考试(初级化学学科知识与教学能力)模拟试卷5
单项选择题
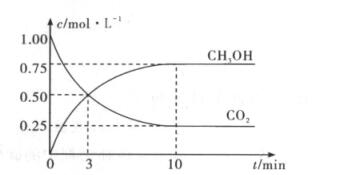
1.已知:CO2(g)+3H2(g) CH2OH(g)+H2O(g) △H=-49 kJ·mol-1,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示。下列说法正确的是 ( )
CH2OH(g)+H2O(g) △H=-49 kJ·mol-1,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示。下列说法正确的是 ( )
 (D)
(D)
A. 3 min时,反应达到平衡状态
B. 10 min时,温度上升,CO2的转化率上升
C. 13 min时,向容器中充入2 mol He,该反应的化学反应速率上升
D. 从反应开始到平衡,用H2表示平均速率v(H2)=0.225 mol·L-1·min-1
解析:3 min时,CH3OH和CO2的浓度相等,但随着时间的推移这两种物质的浓度还在变化,故反应并未达到平衡状态,A项错误。由图像可知,10min后,CH3OH和CO2的浓度不再发生变化,反应已达到平衡状态,因该反应为放热反应,此时升高温度,平衡向逆反应方向移动,则CO2的转化率下降,B项错误。13min时,反应已达到平衡状态,此时向容器中充入2 mol He,因反应是在恒容密闭容器中进行,故反应物浓度不变,反应速率不变,C项错误。v(H2)=3v(CO2)=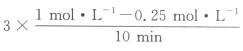
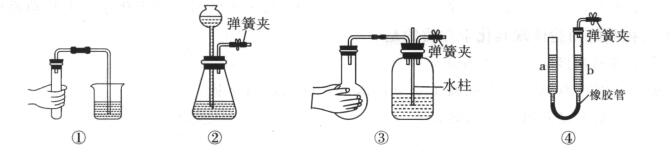
2.下列各图所示装置的气密性检查中,漏气的是 ( )
 (D)
(D)
A. 对装置①,双手移去后,导管中水面高于烧杯内水面
B. 对装置②,长颈漏斗内液面高度保持不变
C. 对装置③,双手移去后,长导管内形成一段水柱
D. 对装置④,上下移动a管后,a、b两端液面仍相平
解析:对装置①,双手移去后,导管内压强减小,外界大气压将液体压到导管中,导管中水面高于烧杯内水面,说明不漏气,A项错误。对装置②,用弹簧夹夹住右侧导管,向长颈漏斗中加水,长颈漏斗内液面高度保持不变,说明不漏气,B项错误。对装置③,用弹簧夹夹住右侧导管,双手捂住烧瓶,烧瓶内气体受热膨胀,使集气瓶中的气体压强增大,松手后,集气瓶中的气体压强减小,使长导管内形成一段水柱,说明不漏气,C项错误。对装置④,用弹簧夹夹住右侧导管,上下移动a管后,a、b两端内形成液面差,并在一段时间内液面差保持不变才能证明此装置不漏气,而上下移动a管后,a、b两端液面仍相平,说明装置④漏气,D项正确。
3.下列推论正确的是 ( )(C)
A. 由HF的稳定性比HCl的强,可推知HF的沸点比HCl的高
B. 由Cl的非金属性比S的强,可推知HCl的酸性比H2SO4的强
C. 由同温度下等浓度的Na2CO3溶液的pH比Na2SO4溶液的大,可推知C的非金属性比S的弱
D. 由某过程中发生化学键断裂,可推知该过程发生了化学变化
解析:元素的非金属性越强,其简单氢化物的稳定性越强,但氢化物的熔、沸点与元素的非金属性无关,而与分子间作用力和氢键有关,所以不能由HF的稳定性比HCl的强推知HF的沸点比HCl的高,A项错误。元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,但HCl不是Cl元素的最高价含氧酸,所以不能根据Cl元素和S元素的非金属性强弱判断HCl、H2SO4的酸性强弱,B项错误。元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,其酸根阴离子的水解程度越小,相同条件下的钠盐溶液的pH就越小,所以由同温度下等浓度的Na2CO3溶液的pH比Na2SO4溶液的大可得出碳酸的酸性小于硫酸的酸性,进而可推知C的非金属性比S的弱,C项正确。化学变化的实质是旧化学键断裂的同时,有新化学键形成。某过程中发生化学键的断裂但不一定有新化学键的形成,所以不一定发生化学变化,如电解质的电离过程虽然发生了化学键的断裂但并没有发生化学变化,D项错误。
4.需要加入氧化剂才能实现下列反应的是 ( )(D)
A. Cl2→Cl–
B. H+→H2
C. MnO2→Mn2+
D. Zn→Zn2+
解析:Cl2→Cl–中Cl元素的化合价降低,则需要加还原剂才能实现,A项错误。H+→H2中H元素的化合价降低,则需要加还原剂才能实现,B项错误。MnO2→Mn2+中Mn元素的化合价降低,则需要加还原剂才能实现,C项错误。Zn→Zn2+中Zn元素的化合价升高,则需要加氧化剂才能实现,D项正确。
5.《义务教育化学课程标准(2011年版)》在“学习情景素材”方面增加了要求学生了解“婴儿奶粉中的蛋白质含量”“常见的食品添加剂,我国使用食品添加
本文档预览:3000字符,共20765字符,源文件无水印,下载后包含无答案版和有答案版,查看完整word版点下载