
中学教师资格考试(高级化学学科知识与教学能力)模拟试卷48
单项选择题
1.下列能反映出固态氨属于分子晶体的事实是( )。(A)
A. 常温下氨是气态物质
B. 氨极易溶于水
C. 氮原子不能形成阳离子
D. 氢离子不能单独存在
解析:分子晶体是通过分子间作用力(包括范德华力和氢键)构成的晶体。分子晶体的熔沸点比较低,离子晶体和原子晶体的熔沸点都比较高。所有常温下呈气态的物质、液态的物质(除汞外),易挥发的固态物质都属于分子晶体。
2.要求设计实验证明某种盐的水解是吸热的,有四位同学分别做出如下回答,其中正确的是( )。(D)
A. 甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液的温度下降,说明盐类水解是吸热的
C. 丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D. 丁学生:在醋酸钠溶液中加入酚酞溶液,加热后若红色加深,说明盐类水解是吸热的
解析:因硝酸铵晶体溶于水吸收热量,则水温下降,不能说明盐水解为吸热反应;中和反应为放热反应,且一水合氨的电离过程为吸热反应,不能说明盐类水解是吸热的;醋酸钠溶液中加入醋酸钠晶体,醋酸根离子浓度增大,促进水解,溶解过程伴随热效应,则不能说明盐类水解是吸热的;醋酸钠溶液中滴入酚酞溶液,加热后若红色加深,则说明升高温度可以促进盐类水解,因此可以证明盐类水解为吸热反应。
3.用NA表示阿伏加德罗常数。下列说法正确的是( )。(C)
A. 78 gNa2O2与足量水反应中电子转移了0.2NA
B. 1 mol甲基中含有7NA个电子
C. 62 g白磷中含有P—P键为3NA
D. 标准状况下,22.4 L水中含氢原子数为2NA
解析:78 g过氧化钠的物质的量为1 mol,1 mol过氧化钠与足量水反应生成0.5 mol氧气,转移了1 mol电子,即电子转移了NA;甲基的电子式为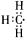
4.下列离子方程式书写正确的是( )。(D)
A. 相同物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2=2Fe3++I2+2Br-
B. 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3.H2O+H2O
C. 向漂白粉溶液中通入适量的二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 稀硝酸中加入过量铁粉,可能发生:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
解析:相同物质的量浓度的FeI2溶液与溴水等体积混合的离子方程式:2I-+Br2=I2↓+2Br-;向Ba(OH)2溶液中加入过量NH4HSO4溶液的离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;向漂白粉溶液中通入适量的SO2,SO2具有还原性,ClO-具有氧化性,二者发生氧化还原反应,离子方程式为Ca2++ClO-+SO2+H2O=CaSO4↓+2H++Cl-。
5.下列说法正确的是( )。(B)
A. 增加体系压强,活化分子百分数增加多,化学反应速率一定增大
B. 升高温度,活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的碰撞均为有效碰撞
D. 加入反应物,活化分子百分数大大增加,化学反应速率增大
解析:增加体系压强,物质浓度增大,活化分子浓度增加,化学反应素速率增大,但活化分子数不变;升高温度,活化分子百分数增加,化学反应速率一定能够增大;活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞;加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大。
6.有一包白色固体,可能有①(NH4)2SO4、②Al2(SO4)3,、③NaCl、④AgNO3、⑤KOH、⑥KI、⑦BaCl2中的一种或几种组成。该固体溶于水得到澄清溶液,而且该溶液能使酚酞溶液呈红色,若在该溶液中加入适量稀硝酸,可得白色沉淀。该白色固体的可能组成是( )。(A)
A. ②③⑤
B. ②⑤⑦
C. ①③④⑤
D. ①④⑤⑦
解析:该固体溶于水得到澄清溶液,则②和⑦不能同时存在,④和⑤不能同时存在,排出B、C、D三项。
7.用下列装置进行相应实验,能达到实验目的的是(
本文档预览:3000字符,共13901字符,源文件无水印,下载后包含无答案版和有答案版,查看完整word版点下载